Hallo zusammen
Von diesem Giftpilz wird viel geredet, aber er ist so selten dass man ihn kaum je zu Gesicht bekommt. Heute hatte ich das Glück ihn anzutreffen. Ein Portrait kann nicht schaden.
Eine Mahlzeit dieses Pilzes ist wohl nicht tödlich, dürfte aber eine der schmerzhaftesten Vergiftungen sein die es gibt.
Paralepistopsis amoenolens (Malençon) Vizzini 2012
= Clitocybe amoenolens Malençon 1975
Parfürmierter Trichterling

Paralepistopsis amoenolens. Standort Leuk CH, Pfynwald, bei Pinus sylvestris.
Hut:
30-100 mm im Durchmesser, jung konvex, dann ausgebreitet und oft unregelmässig verbogen. Teilweise mit stumpfem Buckel.
Cremebeige, an frischen Exemplaren mit typisch dunklerer, rötlichbrauner Mitte. Im Alter rotbraun fleckig.
Oberfläche glatt, matt. Rand glatt oder kurz gerippt.
Lamellen:
Cremefarben, nach Literatur später auch dunkler; deutlich herablaufend; leicht ablösbar (wie bei Lepista-Arten).
Stiel:
40-80 x 5-12 mm, meist nach oben leicht erweitert; jung voll, dann hohl; hutfarben oder etwas heller, meist zur Basis etwas dunkler.
Oberfläche fein faserig.
Fleisch:
Weiss, ziemlich dick und fest. Geruch stark parfürmiert-fruchtig, erinnert an Inocybe fraudans. Geschmack süss, mild.
Sporen:
4.0-5.5 x 3.5-4.5 µm, Q = 1.3-1.7, breit elliptisch, glatt, inamyloid, acyanophil, in Kongorot meist mit einem grossen Tropfen.
Sporenpulver weiss.
Basidien:
Viersporig, bis etwa 40 µm lang.
Zystiden:
Nicht vorhanden, lediglich einige fadenförmige Marginalzellen an der Lamellenschneide.
HDS:
Eine Kutis aus dünnen Hyphen (bis 4 µm dick). Pigment intrazellulär und intraparetial, Schnallen vorhanden.
Habitat:
In der Nadelstreu auf kalkigem Boden. Nach Literatur bei Pinus, Cedrus, Larix, Picea.
Leicht thermophile Art mit mediterranem Verbreitungsschwerpunkt.
Verwechslungsgefahr:
Paralepista flaccida: Ohne parfürmierten Geruch und mit warzigen Sporen.
Infundibulicybe gibba: Ohne parfürmierten Geruch, Sporen mehr tropfenförmig.
Speisewert:
Stark giftig. Enthält ein Neurotoxin, das erst mehrere Wochen nach Verzehr schwere Vergiftungssymptome hervorruft.
Symptome: Finger und Zehen schwellen an, werden rot und schmerzen heftig. Die Symptome treten wellenartig auf, eine Behandlung ist nicht bekannt.
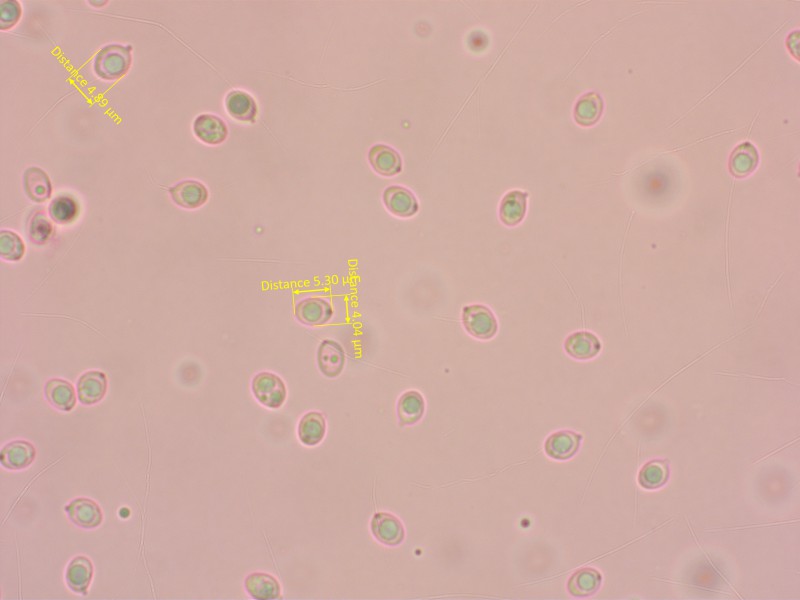
Sporen in Kongorot
Literatur:
Ludwig, E. 2001. Pilzkompendium Band 1.
Vizzini A. & Ercole E. 2012. Paralepistopsis gen. nov. and Paralepista (Basidiomycota, Agaricales). Mycotaxon 120, 253-167.
Eyssartier G. & Roux P. 2017. Le guide des champignons, France et Europe.


